2010년04월13일 20번
[과목 구분 없음] 실험 Ⅰ은 묽은 황산(H2SO4) 50mL가 담긴 비커에 수산화나트륨(NaOH) 수용액을 조금씩 가했을 때, 혼합 용액의 전기 전도도를 측정하여 나타낸 것이다. 실험 Ⅱ는 수산화나트륨 대신에 수산화칼슘(Ca(OH)2) 수용액을 사용하여 실험Ⅰ과 같은 방법으로 측정한 것이다.
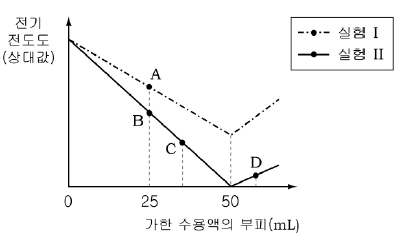
혼합 용액 A ~ D에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]

혼합 용액 A ~ D에 대한 설명으로 옳은 것만을 <보기>에서 있는 대로 고른 것은? [3점]

- ① ㄴ
- ② ㄷ
- ③ ㄱ, ㄴ
- ④ ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
(정답률: 알수없음)
문제 해설
- A 용액: NaOH 용액을 묽은 H2SO4에 가하면 Na+와 OH- 이온이 생성되어 전기 전도도가 증가한다.
- B 용액: NaOH 용액을 묽은 H2SO4에 가하다가 중간에 전기 전도도가 감소하는 지점이 나타나는데, 이는 NaOH 용액이 모두 중화되어 H2O와 Na2SO4가 생성되어 전기 전도도가 감소하기 때문이다.
- C 용액: Ca(OH)2 용액을 묽은 H2SO4에 가하면 Ca2+와 OH- 이온이 생성되어 전기 전도도가 증가한다.
- D 용액: Ca(OH)2 용액을 묽은 H2SO4에 가하면 Ca2+와 OH- 이온이 생성되지만, Ca(OH)2는 NaOH보다 더 약한 염기이기 때문에 생성되는 OH- 이온의 양이 적어 전기 전도도가 낮다.
따라서 정답은 "ㄴ"이다. A, C는 각각 NaOH와 Ca(OH)2 용액을 묽은 H2SO4에 가하면 전기 전도도가 증가하므로 옳다. B는 NaOH 용액을 묽은 H2SO4에 가하다가 중간에 전기 전도도가 감소하는 지점이 나타나므로 옳다. D는 Ca(OH)2 용액을 묽은 H2SO4에 가하면 전기 전도도가 낮아지므로 옳다.
- B 용액: NaOH 용액을 묽은 H2SO4에 가하다가 중간에 전기 전도도가 감소하는 지점이 나타나는데, 이는 NaOH 용액이 모두 중화되어 H2O와 Na2SO4가 생성되어 전기 전도도가 감소하기 때문이다.
- C 용액: Ca(OH)2 용액을 묽은 H2SO4에 가하면 Ca2+와 OH- 이온이 생성되어 전기 전도도가 증가한다.
- D 용액: Ca(OH)2 용액을 묽은 H2SO4에 가하면 Ca2+와 OH- 이온이 생성되지만, Ca(OH)2는 NaOH보다 더 약한 염기이기 때문에 생성되는 OH- 이온의 양이 적어 전기 전도도가 낮다.
따라서 정답은 "ㄴ"이다. A, C는 각각 NaOH와 Ca(OH)2 용액을 묽은 H2SO4에 가하면 전기 전도도가 증가하므로 옳다. B는 NaOH 용액을 묽은 H2SO4에 가하다가 중간에 전기 전도도가 감소하는 지점이 나타나므로 옳다. D는 Ca(OH)2 용액을 묽은 H2SO4에 가하면 전기 전도도가 낮아지므로 옳다.
이전 문제
다음 문제




연도별
- 2016년09월01일
- 2016년07월06일
- 2016년06월02일
- 2016년04월06일
- 2016년03월10일
- 2015년11월12일
- 2015년10월13일
- 2015년09월02일
- 2015년07월09일
- 2015년06월04일
- 2015년04월09일
- 2015년03월11일
- 2014년11월13일
- 2014년10월07일
- 2014년09월03일
- 2014년07월10일
- 2014년06월12일
- 2014년04월10일
- 2014년03월12일
- 2013년11월07일
- 2013년10월08일
- 2013년09월03일
- 2013년07월12일
- 2013년06월05일
- 2013년04월11일
- 2013년03월13일
- 2012년11월08일
- 2012년10월09일
- 2012년09월04일
- 2012년07월11일
- 2012년06월07일
- 2012년04월10일
- 2011년10월12일
- 2011년09월01일
- 2011년07월13일
- 2011년06월02일
- 2011년04월12일
- 2011년02월28일
- 2010년11월18일
- 2010년10월12일
- 2010년09월02일
- 2010년07월08일
- 2010년06월10일
- 2010년04월13일
- 2010년03월12일
- 2009년11월12일
- 2009년10월15일
- 2009년09월03일
- 2009년07월14일
- 2009년06월04일
- 2009년04월15일
- 2009년03월13일
- 2008년11월13일
- 2008년10월16일
- 2008년09월04일
- 2008년07월15일
- 2008년06월04일
- 2008년04월15일
- 2008년03월14일
- 2007년11월15일
- 2007년10월10일
- 2007년09월06일
- 2007년07월12일
- 2007년06월07일
- 2007년03월16일
- 2006년11월16일
- 2006년10월12일
- 2006년09월06일
- 2006년06월03일
- 2006년04월19일
- 2006년03월11일